2020国际亨廷顿病(HD)治疗学大会- 第3天
HDBuzz来自美国棕榈泉的报道:2020亨廷顿病治疗学大会

 Dr Sarah Hernandez, Dr Rachel Harding, 和 Joel Stanton撰写 2020年3月04日 Professor Ed Wild编辑 Xi Cao译制 最早发布于2020年3月03日
Dr Sarah Hernandez, Dr Rachel Harding, 和 Joel Stanton撰写 2020年3月04日 Professor Ed Wild编辑 Xi Cao译制 最早发布于2020年3月03日
瑞秋和莎拉继续为你带来亨廷顿病治疗学会议的报告,这是HD研究人员最大的年度聚会。
记得要看去看第一天和第二天的报道哦。
周四早上-亨廷顿蛋白降低
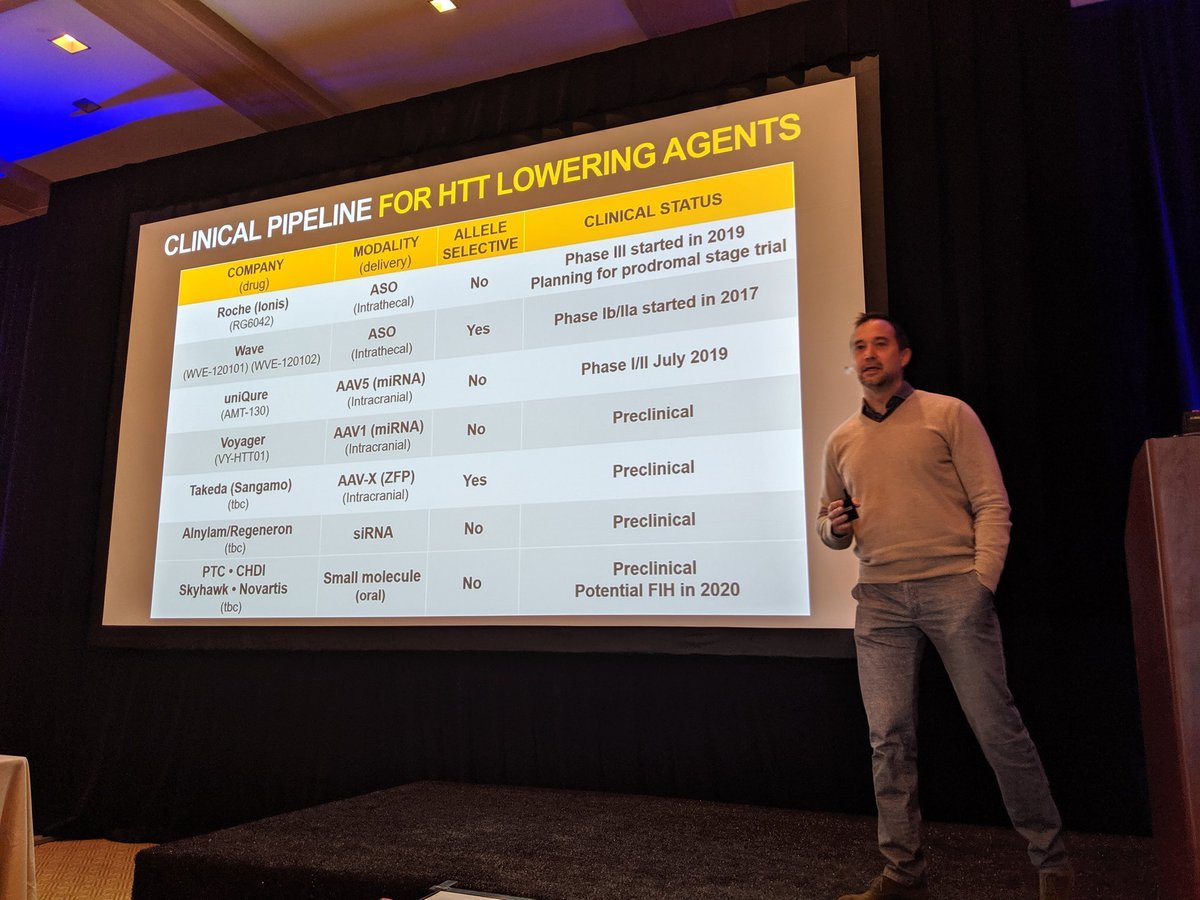
大家早上好!这是在棕榈泉举办的CHDI会议的第三天,会议的主题是降低亨廷顿蛋白,有很多研究人员和公司都对这个主题非常感兴趣!
降低小鼠和大鼠的亨廷顿蛋白(HTT)确实能够帮助缓解它们的HD症状和进展,在其他动物中降低HTT也是可能的。然而关键的问题是我们能否降低人类的HTT,以及这个是不是有助于治疗病人。还有我们应该在什么时候降低亨廷顿蛋白?应该在病人出现症状之前还是以后开始治疗?我们需要去降低特定脑区的亨廷顿蛋白吗?还是应该在整个大脑中进行?目前开展的一些临床试验就在试图解答这些问题。
临床试验将有助于我们回答这些问题。科学家们已经开发出许多方法来尝试降低HTT,以及各种工具来测量大脑中的HTT水平。还有很多其他的策略正在酝酿中。
今天的第一位讲者是来自CHDI的Ignacio Munoz Sanjuan,讨论HTT降低疗法的时机。他也非常积极地参与拉丁美洲的患者活动。Munoz Sanjuan创立了一个关爱患者的非营利组织,名为Factor H.
科学家们希望确保他们开发的疗法对病人都是安全的。HD是一种影响全身的疾病,所以当我们关注在大脑中降低HTT时,了解这个治疗对整个患者的影响也是很重要的。神经退行性病变是一个很难的挑战——阿尔茨海默氏症和帕金森氏症等其他领域的科学家也很关心如何给患者带来最好的治疗,研发这些新药不是一件容易的事情,因此我们应该谨慎前进。
小分子是降低HTT的一个有吸引力的研发领域。小分子是可以作为药丸服用的药物,所以很多人对进一步发展这个策略很感兴趣。但这个策略可能针对的是整个HTT,而不是仅仅针对突变的HTT。降低HTT的一个关键问题是时机——我们应该什么时候开始治疗?我们能逆转已经造成的损害吗?或者我们能在疾病后期进行治疗吗?研究人员不想给病人服用不必要的药物。大脑是一个非常复杂的器官,重要的是,虽然老鼠模型对于研究HD进展的某些方面是有用的,但老鼠的大脑终究不是人的脑。使用许多不同的HD模型是研究药物如何发挥作用的关键。然而,小鼠模型对推进HD研究至关重要。由于治疗时机是一个热门话题,研究人员一直在关注小鼠细胞效应逆转的情况。纹状体神经元是HD患者大脑中受影响最大的细胞类型,而研究人员发现降低小鼠的HTT可以预防和逆转纹状体神经元的缺陷,这是非常好的消息!
现在,我们展望以下HD生物标志物的前景。HD生物标志物是科学家可以在病人身上监测HD进展的措施。好的生物标记物可以帮助临床医生了解如何以及什么时候给患者提供最好的治疗。CHDI花了很长时间开发新的成像技术,让我们可以看到大脑中有多少HTT,以及这些HTT在哪里。他们开发了一种新的分子,当HTT蛋白分子组成特定的团结结构时,这种新分子能够粘附它。因为它显示的扫描仪被称为PET扫描仪(正电子发射断层扫描),所以它叫PET指示剂或PET配体。 这种分子能够进入大脑,因此可以用来帮助追踪HTT降低。CHDI的团队已经在不同的HD小鼠模型中测量了这些HTT团块的降低。他们试图在小鼠大脑的不同区域降低HTT,同时也治疗不同年龄的小鼠。
科学家们试图回答的另一个问题是,我们应该在细胞中降低多少HTT蛋白?什么水平的降低可能有助于治疗患者?什么水平的降低是安全的?我们可以使用HTT 的PET配体和其他实验来测量治疗后的降幅,然后可以看到在哪些降幅这些小鼠模型可以出现好转。这可能有助于将老鼠模型中的发现转化到人类的应用。
下一位讲者是来自西北大学的马克·贝文(Mark Bevan),他的研究是在一个特定的大脑区域降低HTT。
贝文的研究集中在某些大脑区域的HTT降低如何改变大脑的工作方式,以及这会如何影响患者的症状。和许多其他人一样,贝文对HD引起的细胞的类型特异性差异感兴趣。他的研究小组发现,在HD小鼠模型中,特定种类的神经元活性较低,同时其他的神经元似乎没有受到影响。通过观察小鼠的HD模型,他发现神经元之间的交流方式存在差异,因此利用神经元间交流实验来观察在这些小鼠中降低HTT产生的效果。通过降低HD小鼠的HTT,他发现运动缺陷得到了改善,小鼠能够以更快的速度移动更长的距离。这是个好消息,因为在目前的人类临床试验中,还没有披露他们在患者症状上观察到的变化的数据。贝文和他的同事们正在继续研究小鼠模型中HTT降低对其他运动缺陷的影响,他们希望他们的发现能为HTT降低疗法如何应用于临床提供参考。
接下来是来自马萨诸塞州总医院的马西·麦克唐纳(Marcy MacDonald),他的演讲有一个有趣的名字 “外部限制”!从Enroll-HD的研究中,研究人员发现除了CAG长度之外,还有很多来自其他因素的变量。 这是HD领域的一个重大发现,尽管我们已经知道疾病的遗传原因,新的发现再次告诉了我们这种疾病有多么复杂。非常感谢参加Enroll-HD登记的所有人。你可能已经注意到一个主题,很多研究人员正在充分利用你提供的数据-再一次感谢你的付出!虽然我们都有HTT基因而HD患者的CAG长度比其他人长,我们的HTT基因序列也有一些其他小变异,像MacDonald这样的研究人员有兴趣进行研究并作为潜在的治疗目标。
关于改变HD疾病进展的因素,麦克唐纳的团队已经在生成大量的数据。他们分享了所有数据,让全世界的科学家能够一起研究它——人多力量大。很偶然的是,麦克唐纳也找到了HTT被降低了的人。这些人状态都很好,所以研究人员知道,将HTT降低到这个水平应该不会产生有害影响。由于HTT在人群中的表达水平都不一样,而且这些人看起来都很好,这对于HTT的降低疗法来说真的是个好消息。这表明改变HTT水平可能不会产生负面影响。但有一点需要注意,当降低HTT时(特别是在肝脏),小鼠模型中的细胞承受压力的能力也会降低。因此,对于研究人员来说,彻底测试所有HTT降低疗法的安全性也是非常重要的。
由于HTT在人群中的表达水平不一样,研究人员还需要注意的是在HTT降低试验中,试验开始时病人们的HTT水平可能也不一样。因此,我们可以想象,未来可能会为每个患者采用更适合个人的疗法。这些都是进行HTT降低试验的公司在试验设计中需要考虑的要点。
星期四下午-亨廷顿降低的临床治疗

下午的重点是将HTT降低转化为临床治疗。第一位讲者是夏洛特·萨姆纳(Charlotte Sumner),来自约翰霍普金斯。她将讨论一些与靶向基因治疗相关的挑战。
虽然萨姆纳主要关注的是是脊髓性肌萎缩症(SMA),一种不同的神经退行性疾病。目前有一种治疗SMA的ASO疗法,所以HD领域可以从他们的经验中学到很多。与HD相似,我们知道SMA的确切遗传原因。然而,我们对细胞中蛋白质分子的情况的理解却有些模糊,因此还不能完全明确疾病的驱动因素。因为疾病的遗传学是明确的,有几种不同的基因疗法已经研发出来用于治疗SMA。除了已经批准上市的ASO疗法外,还有一些小分子药物(药片服用)目前已经提交美国FDA审批。单剂量或“一次注射”的基因替代疗法(直接解决DNA序列)也被证明对患有SMA的幼儿有效,目前正在研究这种疗法是否对年纪大些的患者有效。SMA试验中的一些患者在各种测量指标上都有显著改善。这些发现对于HD研究领域是非常鼓舞人心的,我们希望将SMA治疗领域发现的一些成功策略应用到HD研究中。在会议的早些时候,我们在推特上发布了一些研究人员对治疗HD的最佳时机感兴趣。而在SMA领域,他们发现治疗时机确实很重要,所以我们很高兴看到HD研究在正确的道路上前进。
由于一些SMA患者对治疗的反应不同,SMA研究人员渴望获得更多的患者数据,以了解这种变化的潜在原因。这就显示了像Enroll-HD这样的研究对HD领域的研究有多重要。现在SMA的研究人员正试图找出治疗和监测病人的最佳方法,也就是给多少药?什么时候给药,多长时间给一次?这将有希望进一步改善患者的预后。同样,与HD类似,SMA研究人员也对神经丝(NfL)作为疾病进展的生物标志物感兴趣。他们正在监测接受不同SMA治疗的患者的神经丝水平,神经丝水平似乎随着治疗时间的推移而下降。
阿纳斯塔西娅·赫沃罗娃(Anastasia Khvorova)来自自马萨诸塞大学医学院,她分享了如何使用一种叫做RNAi的技术来降低HTT。与ASOs类似,RNAi疗法以HTT的信息为靶点,而不是DNA或蛋白质,作用是破坏中间步骤、阻止蛋白质的产生。
为了测试RNAi靶向HTT治疗对疾病的影响,赫沃罗娃的团队首先分析了在小鼠模型中的影响。第一步是测量治疗在大脑中的扩散范围—也得到了非常有利的结果!在治疗后,他们发现在大脑的许多区域的HTT显著降低。这项研究针对的是正常和突变的HTT,但他们也正研究只针对突变的HTT的方法。通过对RNAi分子进行一些巧妙的调整,她的团队能够使他们的治疗只对突变HTT的信息有选择性,因此只有这种蛋白质会被降低。然而,需要注意的是,这只适用于约35%的患者,因为这些人的HD基因序列中有一个叫做SNP(读作snip)的微小差异。这让RNAi治疗能够去选择性地针对突变HTT。接下来,他们想看看他们的RNAi治疗在更大的动物模型中是如何工作的,所以他们从老鼠转移到了绵羊。利用绵羊,他们测试了各种给药方法,发现它们可以注射到大脑或脑脊液中并产生相同的效果。
在绵羊之后,赫沃罗娃的团队开始研究猴子模型,再次发现RNAi治疗在整个大脑和脊髓中扩散得相当好,药物在这些区域存留了相当长的时间,因此不需要非常频繁的治疗。 在这些猴子的早期安全性研究中,这种疗法在测试的剂量下看起来是安全的。令人兴奋的消息是,在猴子的早期研究中,HTT显著降低。没有发现其他基因的水平出现变化,这意味着试验观察到的脱靶概率或副作用似乎是比较小的。尽管如此,寻找其他基因的微小变化还是很重要,团队正在进行这项工作,以确保没有差异,并确认这种疗法的安全性。赫沃罗娃的团队和CHDI都认为这项技术是非常有前景的。它可以用来调节大脑中其他蛋白质的水平。他们的一个关注点是成本。他们正在努力降低成本,希望能够提供给所有的HD患者。我们很期待更多关于这项有希望的研究走向临床治疗的进展!
我们的下一位发言人是来自uniQure的Astrid Valles Sanchez,分享uniQure的降低HTT疗法。UniQure用一种叫做AMT-130的治疗方法来降低HTT,目前正在进行人类临床试验来确定这种治疗的安全性。AMT-130是一种希望通过一次性注射到大脑、来降低HTT的药物。他们正在评估生物标记物,来衡量这种治疗对改善HD疾病进展的是否有效。当观察猪模型时,他们发现在长达两年的时间内,药物都能在脑脊液中被检测出。在猴子模型中,当猴子被处死的时候,他们发现药物存留时间长达6个月。与其他研究一样, uniQure想知道这种治疗是否在大脑中有很好的扩散,从而了解它可能在哪些区域起作用。在治疗12个月后的猪模型中,他们分析了来自大脑不同区域的组织,以观察他们的治疗在降低HTT方面效果如何。他们发现,在受HD影响最严重的脑区,突变的HTT出现了显著降低,且降低幅度最大。uniQure还观察了用AMT-130治疗HD猪模型后,脑脊液中突变HTT水平,但在这个特殊的实验中,脑脊液中的HTT水平与大脑中发现的HTT水平无关。uniQure的科学家们对使用磁共振波谱(MRS)这一非侵入性的方法来观察大脑感兴趣,看看在治疗后大脑的不同区域是否发现了代谢物这种化学物质的任何变化。
会议的最后一位讲者是斯科特·肖贝尔(Scott Schobel),他分享了罗氏试验的一些新的初步结果。这些结果来自于有症状的HD患者的15个月的开放标签延长试验,我们在解读这些数据时应该谨慎一点,因为这些是非常早期的数据,但是看到这些发现还是挺兴奋的。
罗氏的正在研发的药物RG6042换了一个新名字,叫tominersen,以后都会用这个名字。有一些患者参与了药物最初的安全性试验,他们也继续参加了延长期开放研究(OLE),也就是在安全性试验结束后,他们会继续接受治疗,我们今天将看到的数据是自安全性研究结束以来科学家们发现的。这种疗法没有选择性,它的目的是在降低正常和突变的亨廷顿蛋白水平。罗氏公司及其合作者多年来一直致力于研究不同的动物模型,以确定亨廷顿蛋白的水平需要有多大的降幅,以及如何通过观察脑脊液来测量蛋白质的降幅。两年前在CHDI会议上,UCL的Sarah Tabrizi发表了安全性研究的第一个研究结果。在短短的两年内,我们在HTT降低方面就已经取得了巨大的进步!
从安全性试验来看,tominersen可以剂量依赖性地降低HTT蛋白水平。这意味着,在接受治疗的患者中,接受更多剂量的患者体内的蛋白质降幅更大。在随后的延长期开放研究(OLE)中,测试了两种给药策略-受试者每月给药或者每两个月给药。这种试验设计对于确定患者需要服用tominersen的频率至关重要。他们发现,即使每两个月接受一次治疗的小组,也能观察到HTT蛋白的明显降低。这两个病人组的大部分人都完成了这项延长研究-非常感谢这些病人对试验的参与!综合考虑罗氏检测的指标,数据表明tominersen应该每两个月治疗一次而不是每个月治疗。因为他们发现较不频繁的给药对降低HTT有效,因此他们修改了临床3期试验的策略,减少给药次数到每16周给药一次,对患者来说负担更小!
目前认为神经丝(NfL)是一种可以用于监测疾病进展的HD生物标记物,追踪神经丝的水平可能有助于了解治疗的有效性,罗氏正在继续研究临床试验中的神经丝水平。他们发现,NFL水平在初期有上升,但随着时间的推移出现下降,甚至在15个月试验结束的时候出现持平。罗氏有兴趣进一步了解NfL生物标记物,也正在研究HTT和NfL的潜在生物学联系。罗氏公司正在进行更多的临床工作,希望能继续跟HD研究社群对这个药物的疗效有更多的分享。[肖贝尔已经在网上分享了他的幻灯片](http://bit.ly/2tK3W0D)!
今年的大会到此为止我们希望你会喜欢我们的报道!敬请期待明年的大会报道!


