
2020国际亨廷顿病(HD)治疗学大会- 第1天
HDBuzz来自棕榈泉的报道2020亨廷顿病治疗学大会
我们的新写手蕾切尔·哈丁和莎拉·赫尔南德斯在这里为大家报道亨廷顿病(HD)治疗学大会,这是HD研究人员最大的年度聚会。
星期二上午-HD基因型和表型
来自阳光灿烂的棕榈泉的问候!我们很高兴来到这里参加第15届亨廷顿病治疗学大会。 今年除了Ed和Jeff之外,我们还有HD Buzz的最新作家——蕾切尔·哈丁和莎拉·赫尔南德斯博士。乔尔·斯坦顿会将我们在推特上的发布整合成每天的文章。

第一环节是“基因型和表型”,讨论的重点是HD的基因突变(基因型)如何改变HD的症状(表型)。首先是塞思·阿门特(Seth Ament)博士,他的实验室试图绘制携带HD突变的小鼠脑细胞发生的第一次变化。我们大脑和身体里的细胞都有DNA,DNA可以编码超过20000多个基因。在一个细胞中,哪些基因被打开或者关闭决定了这个细胞的工作方式。阿门特的实验室一直在研究什么样的基因被表达的这种转变,并试图了解让HD细胞表达不同基因集的特定因素,希望可以修复它。
阿门特首先从绘制亨廷顿蛋白粘附到DNA的位置图开始,亨廷顿蛋白是HD基因的产物。亨廷顿蛋白能够通过直接粘附在DNA上来改变哪些基因被打开/关闭。事实上,与普通小鼠相比,亨廷顿蛋白会粘附HD小鼠基因组中的不同部分。这表明亨廷顿蛋白可能直接对DNA做了一些事情,这一点可能对理解HD很重要。
在突变HD小鼠中,亨廷顿蛋白会在活跃的地方粘附在DNA上,这些地方的基因一直被读取和使用。这表明突变亨廷顿蛋白可能在基因被积极利用的领域发挥了独特的作用。亨廷顿蛋白在不同区域与DNA结合的这种变化,是否有助于解释携带突变亨廷顿蛋白的细胞是如何变得有些混乱的?
这是有可能的,鉴于亨廷顿蛋白在突变小鼠身上所粘附的区域,包含着在HD细胞中发生变化的基因。阿门特的团队有一个惊人的发现:可以通过亨廷顿蛋白与DNA的结合程度来预测给定区域的活性或非活性。
接下来,阿门特讲述了他的实验室为绘制HD大脑中哪些基因发生改变所做的努力。惊人的新技术使研究人员能够绘制单个细胞的基因图谱。他的实验室在美国国立卫生研究院(NIH)的大脑计划中使用这些技术。阿门特的实验室利用这些新技术检测了13000多个来自HD小鼠大脑细胞的变化。大脑中有许多不同类型的细胞,而阿门特可以分别绘制每种细胞类型的变化图。这比混合在一起分析,能够提供一幅更清晰的画面。这些结果为更精确地理解每种类型的细胞中究竟发生了什么奠定了基础,这可能有助于我们理解如何单独去对待每种类型的细胞。
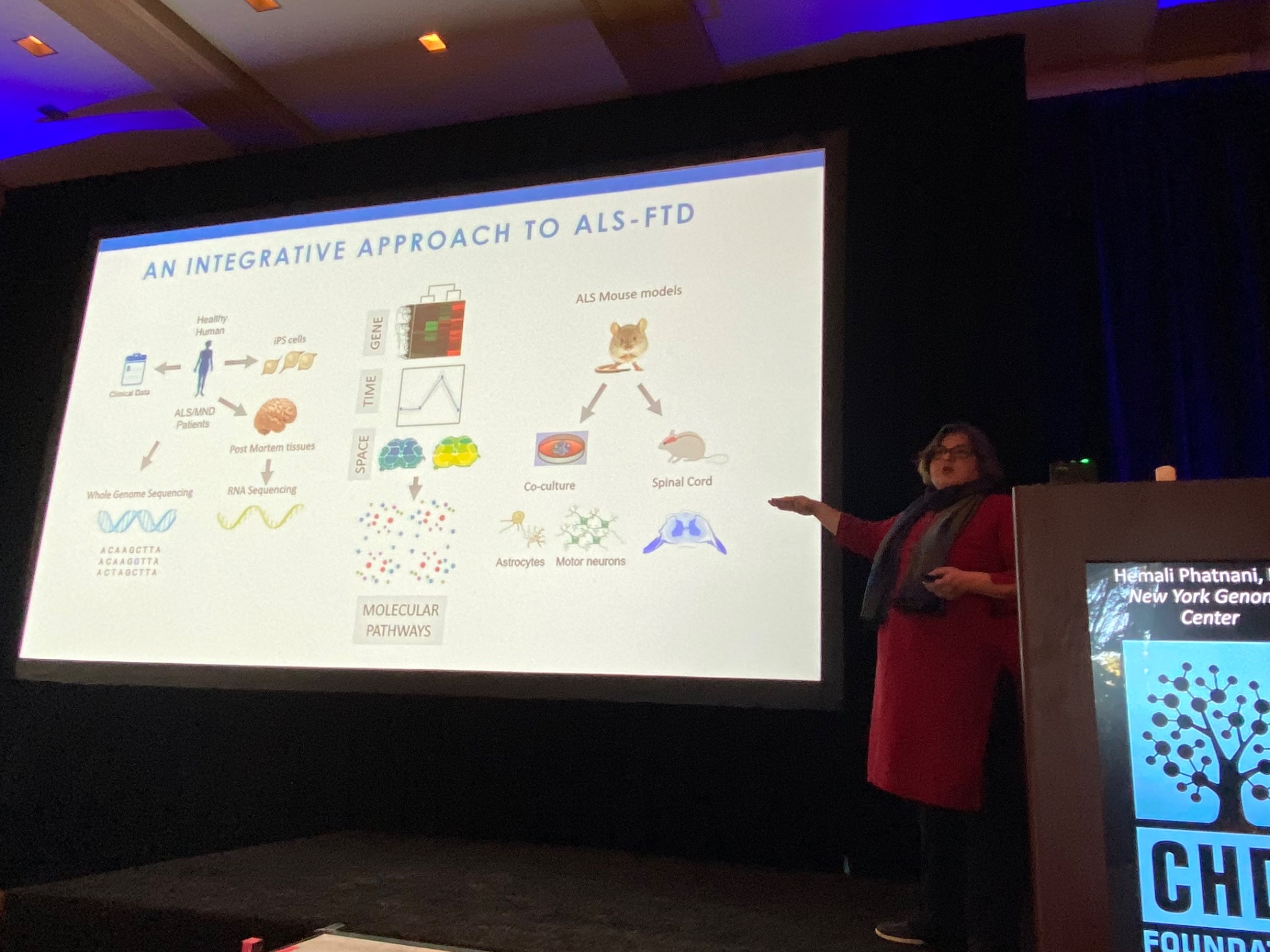
下一位的讲者是来自纽约基因组中心的Hemali Phatnani,她分享了她对ALS(渐冻症)或另一种叫做FTD的相关疾病患者的大脑和脊髓变化的研究。Phatnani与ALS诊所的一个大型团队合作来获取ALS患者捐赠的样本。分析后的数据会马上分享给世界各地的研究人员,这是一个非常好的开放科学模型!和HD一样,ALS也是一种复杂的疾病,在发病过程中,大脑中不同类型的细胞会经历不同的变化。Phatnani的团队已经帮助开发了新方法来绘制ALS脑细胞的变化图。他们的技术允许他们研究细胞特定的变化,研究人员(或好奇的非研究人员)可以在als-st.nygenome.org网站上探索他们的数据。
接下来的讲者是来自华盛顿大学医学中心的Sumanjit Jayadev。Jayadev对研究小胶质细胞感兴趣,这是一种的特殊类型的脑细胞。小胶质细胞在HD的疾病进展中起着重要作用,而在小鼠模型中去除小胶质细胞有助于改善HD症状。科学家们已经知道HD会引起炎症反应,Jayadev对哪些脑细胞(神经元除外)在炎症反应中起作用感兴趣。炎症相关的基因是阿尔茨海默病(AD)的危险因素。Jayadev正在研究这些基因在大脑中的哪些细胞被激活,从而利用一种在单细胞水平提供数据的技术来识别疾病风险。通过研究单个细胞的这些变化,研究人员能够识别小胶质细胞的亚型,并且通过观察这些亚型,发现了一种只存在于AD中的特定类型的小胶质细胞。Jayadev正在与Sage Bionetworks的人合作,这是生物医学研究中开放科学和开放数据方面的专家。所有的数据生成后,就可以通过观察哪些基因在何时何地被打开,来监测AD的疾病进展。这有助于定义不同人群的患者,从而帮助临床医生和研究人员了解疾病过程是发展的。如果我们可以将其应用于HD,那么也许在未来通过了解患者的年龄和CAG长度,医生可以就如何治疗这个患者做出更适合的决定。
上午最后一个讲者是加州大学洛杉矶分校(UCLA)的威廉.杨的演讲。杨的实验室从不同的HD小鼠模型中产生了大量的数据集,研究了不同基因是如何被打开的,哪些蛋白质存在于不同的细胞类型中,并将所有这些数据汇集在一起,将HD组和对照组进行比较。
在这些大数据集中,科学家搜索可能表明一些基因如何在HD小鼠模型中协同工作的模式和相关性。这些模式可以通过计算方法绘制出来,以了解大脑中的某些细胞类型是如何影响他们观察到的基因表达变化的。
在本次演讲中,杨将重点放在使用没有携带HD的对照小鼠所做的分析上,他的团队展示了这项技术能够识别重要功能以及哪些细胞类型对这些功能有贡献。当HD小鼠模型的数据覆盖在图上时,他们发现调节睡眠/觉醒周期和DNA修复和改变的基因-证实了研究人员以前的研究结果。这张图也可以用来测试许多HD相关的新理论一个很棒的工具!
星期二下午-体细胞不稳定性
下午的课程重点是体细胞不稳定性。简单地说,当过度重复的DNA序列在某些细胞类型中出现不稳定时,就会发生体细胞不稳定。
今天下午首第一位讲者是来自格拉斯哥大学的达伦·蒙克顿。他的研究方向是体细胞不稳定性如何驱动亨廷顿病,以及如何利用这种不稳定性作为靶点来进行HD新药研发。我们已经知道,CAG的长度可以在身体组织中变化,有些细胞的CAG长度比其他细胞长得多。这与我们在其他类似疾病如强直性肌营养不良中看到的情况相似,随着患者年龄的增长,CAG重复长度的变化越来越大,表明存在更多的不稳定性。同样,CAG重复越长,变异性越大,因此引发的不稳定性也就越多。值得注意的是,这并不意味着你的CAG重复数会随着年龄的增长而变长,这个是不变的。这仅仅意味着在某一些细胞中,CAG重复长度有时会增加。
CAG编码氨基酸谷氨酰胺,有人也把 HD叫做多聚谷氨酸病。但是谷氨酰胺也可以由CAA来编码,所以尽管DNA不同,但用一个CAG替换CAA生产的蛋白质是相同的。例如在HD基因中,长的“C-A-G”重复在某些细胞类型中会变得更长。
最近一项有趣的发现表明,用CAA在某些地方代替CAG,在保持重复长度稳定性方面更好。那么接下来的问题就是,什么推动了这些引发体细胞不稳定性的改变?证据并没有指向DNA修复,这是最近HD研究的一个热点话题。
识别这种不稳定的特定“驱动因素”(或基因)可能对HD有治疗意义。研究人员目前正在努力弄清楚哪些驱动因素对患者最重要,以及哪些驱动因素适合用做新疗法/药物的靶点。现在,研究人员正在观察CAG长度的不稳定性/变化是如何随时间而变化的,这都要感谢那些为EnrolHD研究提供样本和数据的患者。
如果我们可以通过简单的血液测试来测量体细胞不稳定性,用来来监测和跟踪HD的进展,这对医生来说是一种相对简单的监测病情进展并提供最佳治疗方案的方式。
接下来的讲者是来自美国国立卫生研究院(NIH)的Karen Usdin,Usdin一直在研究另外一种疾病的小鼠模型中的体细胞不稳定性,这种疾病叫做脆性X综合征,影响神经系统。和HD类似,脆性X综合征是一种CGG重复过度导致的疾病。我们可以从其他这种类似过度重复的基因序列引发疾病中学到很多,因为科学家认为,这些疾病的驱动因素有很多相似之处。与HD一样,导致脆性X的CGG重复序列也受到体细胞不稳定性的影响,参与DNA修复的基因也影响着这一过程。Uddin发现,至少在脆弱的X小鼠中,改变DNA修复基因的水平可以阻止CGG重复序列的扩展,甚至能够移除一些重复序列!在这次会议上,能听到来自HD领域之外的科学家们的声音真是太棒了,他们分享了很多有趣的想法和知识,这可能有助于推动HD研究更快地向前发展!
今天的最后一个话题是来自CHDI的Ravi Iyer,他讨论了科学家们感兴趣的一个药物发现项目。这项药物发现计划的目标之一是识别小分子。CHDI正与许多不同的公司合作,使用许多不同的技术来发现小分子——在这些棘手的项目上的合作有助于加快进展。
判断小分子是否有可能有效的一种方法是,通过观察他们想要瞄准的分子结构的详细模型,例如参与DNA修复的蛋白质。小分子的优点是,一旦被证明是治疗HD的有效药物,那么它们可以作成药丸服用。虽然小分子药物的前景非常令人兴奋,但研究人员必须格外小心,他们希望使用的小分子不会产生意想不到的副作用。
制造小分子药物可能是一个令人兴奋的项目,但我们仍然远远没有了解这是否会成功。由CHDI领导的一个大型科学家团队正在为此而努力,我们也会很快获知最新进展。
现在我们来听Triplet Therapeutics的Brian Battencourt的发言,Triplet Therapeutics是该领域的众多公司之一,他将告诉我们更多关于针对体细胞不稳定性的治疗方法。他们的目标之一是阻止CAG过度重复导致的体细胞不稳定性,并延缓HD的发病。这是一个非常有前途的研究领域,科学家们需要优先考虑首先研究哪些分子。这使他们能够朝着尽快开发有前途的HD治疗方法而努力。在优先考虑安全性和低风险后,Bettencourt的研究小组开发了针对8种不同基因的分子。虽然这也是一个很大的目标,但可以相对较快地完成。同样,这项研究是一个更大的合作的一部分,因为他正在和HDBuzz的主编杰夫.卡罗尔一起研究这些不同的潜在治疗目标。Bettencourt的研究小组明年应该会对这些研究进行报告,我们会继续关注是否可以利用靶向性体细胞扩张来治疗HD。
今天的最后一位发言者是HDBuzz的主编杰夫.卡罗尔,他总结了本次体细胞不稳定性的环节。卡罗尔的研究方向之一是理解降低亨廷顿蛋白对非大脑组织(如肝脏)的影响。有趣的是,降低亨廷顿蛋白可以减少某些组织的体细胞不稳定性,而不是其它组织。卡罗尔实验室希望更详细地了解这些发现,因此正与Sarah Tabrizi合作研究人类神经元细胞。在没有HD(但有共济失调,一种不同的CAG重复疾病)的不同小鼠模型中,亨廷顿蛋白的降低表明体细胞的不稳定性也降低了,这表明亨廷顿蛋白可能在体细胞不稳定性中也有一些作用。如果亨廷顿蛋白在基因组稳定性中发挥作用,卡罗尔的实验室将致力于研究这可能是如何发生的,以及这将如何影响HD患者。这是一个非常新的观察结果!
第一天的会议就到此结束!请继续关注我们第2天和第3天的报告!




