
2020国际亨廷顿病(HD)治疗学大会- 第3天
HDBuzz来自美国棕榈泉的报道:2020亨廷顿病治疗学大会
Rachel and Sarah report from the Huntington’s Disease Therapeutics Conference – the biggest annual gathering of HD researchers.
Be sure to catch up on Day 1 and Day 2.
Thursday morning – Huntingtin lowering
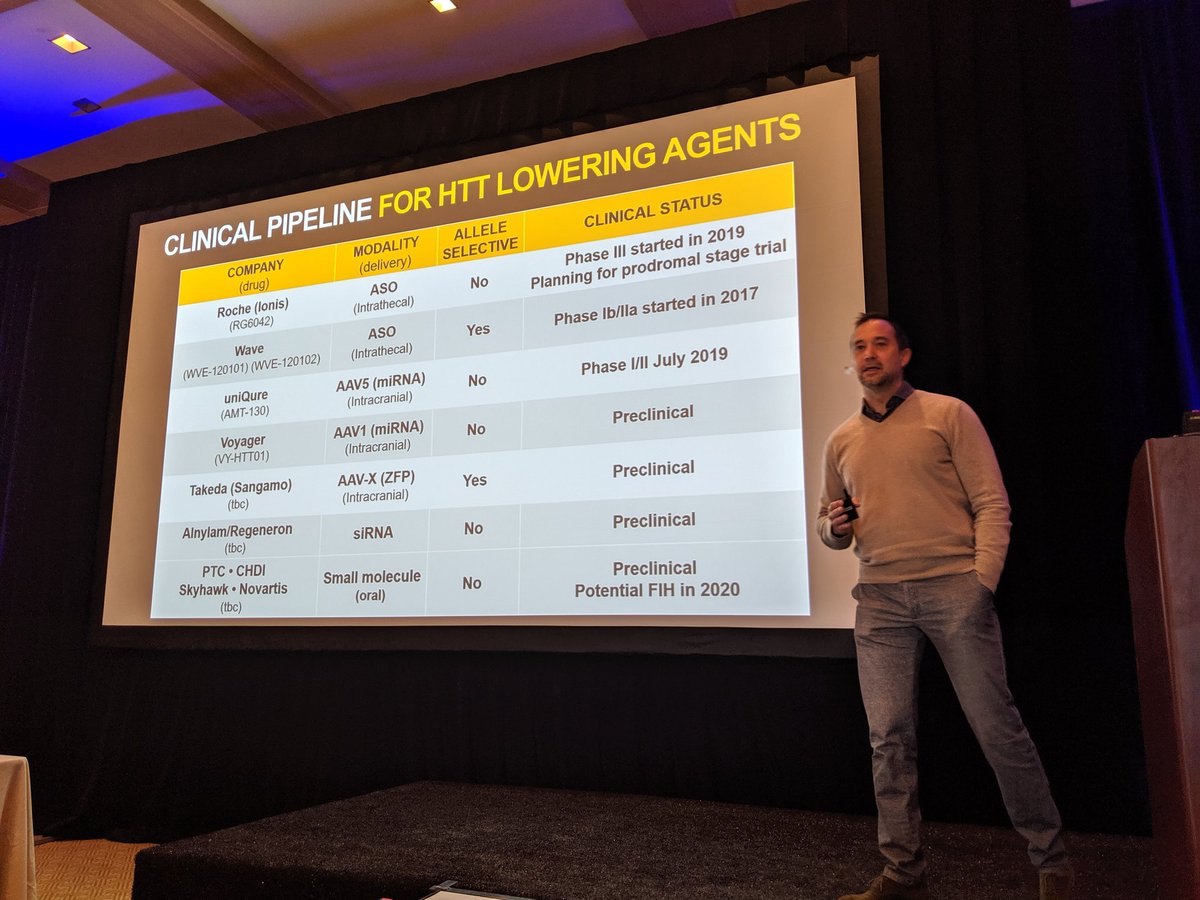
Good morning everyone! We are back for Day 3 at the CHDI meeting in Palm Springs which is all about huntingtin lowering. There are a LOT of researchers and companies interested in huntingtin lowering!
We know lowering huntingtin protein (HTT) in mice and rats does help with HD symptoms and progression, and that it is possible to lower HTT in other animals. However, the million dollar question is whether we can lower HTT in humans and whether this helps treat patients. Other big questions are when we should lower HTT – do we need to do this before patients show symptoms, or later? And do we need to lower HTT in specific brain areas? Or should this be done in the whole brain? All things that current clinical trials are trying to answer.
We can be optimistic that clinical trials will help us answer these questions. Scientists have developed lots of ways to try and lower HTT as well as all sorts of tools to measure HTT levels in the brain. There are also a lot of alternative strategies in the pipeline.
Our first speaker is Ignacio Munoz-Sanjuan from CHDI, discussing the timing of HTT lower strategies. Munoz-Sanjuan is also very actively involved in patient outreach in Latin America. Munoz-Sanjuan started a non-profit centered around his efforts in patient outreach called Factor H.
Scientists want to make sure any therapies they develop are safe for patients. HD affects the whole body so whilst we focus on HTT lowering in the brain, its important to understand the effects of treatment on the whole patient. Neurodegeneration is a difficult problem to target – scientists in other fields such as Alzheimer’s and Parkinson’s are also concerned about how best to treat patients, it’s not an easy task to make these new medicines, so we should be cautious moving forward.
One attractive area for HTT lowering are small molecules. These are medicines that would be taken as a pill, so lots of people are quite interested in developing this strategy further. But this likely wouldn’t specifically target expanded HTT, but rather total HTT. One key question in HTT lowering is timing – when should we be treating to stop the disease? Can we reverse any damage that has been done or can we treat at later disease stages? Researchers don’t want to give unnecessary medicines to patients if they don’t have to. The brain is a really complex organ and it is important to remember that while mouse models are useful for investigating some aspects of HD progression, a mouse brain is not a human brain. Using lots of different models of HD is key for studying how well drugs might work. However, mice are critical for advancing HD research. Since timing of treatment is a hot topic, researchers have been following what happens to reversal of cellular effects in mice. Very excitingly, researchers are finding that HTT lowering in mice can prevent and reverse deficits in striatal neurons – the most affected cell type in the brain of HD patients – amazing news!
Now, we move onto the promise of HD biomarkers. A quick recap that these are the measures scientists can make in patients to track how HD is progressing. Good biomarkers can help inform clinicians on how and when to best treat patients. CHDI has spent a long time developing new imaging techniques that will let us visualise how much HTT is in the brain, and whereabouts it is. To do this, they have developed a new molecule that specifically binds to the HTT protein molecule when it forms into certain clump structures. This is called a PET tracer or PET ligand, because the scanners it shows up in are called PET scanners – short for positron emission tomography. The molecule is able to cross into the brain so could be used to help track HTT lowering. Already, CHDI and team are measuring lowering of these HTT clumps in different HD mouse models. They are trying HTT lowering in different areas of the mouse brain and also treating mice which are different ages.
Another question scientists are trying answer is by how much should we lower HTT protein in cells? What level might help treat patients? What levels are safe? We can use the HTT PET ligand and other experiments to measure the lowering levels after treatment and can then see which mouse models recover at which levels of lowering. This might help translate discoveries from mice to humans.
The next speaker is Mark Bevan from Northwestern University, discussing his work lower HTT in a specific brain region.
The research Bevan is sharing with us today is focused on how HTT lowering in certain brain areas might change the way the brain works and how this could affect symptoms in patients. Like many others, Bevan is interested in cell type-specific differences caused by HD. His group is finding that specific kinds of neurons are less active, while others seem to be unaffected in mouse models of HD. By looking in HD models of mice, Bevan has found that there are differences in the way neurons talk to one another and is using his experiments looking at neuron-to-neuron communication to study the effect of HTT lowering in these mice. By lowering HTT in HD mice, Bevan is seeing that motor deficits are improved – the mice are able to move longer distances at a faster speed. Great news since current human clinical trials haven’t yet disclosed data regarding changes they might be seeing in symptoms. Bevan and colleagues are continuing to look at HTT lowering on other motor deficits and so forth in their mouse models.They hope their findings might inform how HTT lowering therapies could translate to the clinic.
Next up is Marcy MacDonald from Massachusetts General Hospital whose talk is intriguingly titled “the outer limits”! From the Enroll-HD study, researchers are finding there is lots of variability that comes from factors other than CAG length. While this has been a big finding in the HD field, it really indicates how complex this disease is, even though we know the genetic cause. Another huge thanks to all the Enroll-HD participants. Hopefully you’ve noticed a theme that many researchers are making great use of the data you’re providing – thank you! While we all have the HTT gene and HD patients have a longer CAG than others, we also have other small variations in the HTT gene sequence that researchers like MacDonald are interested in studying and targeting therapeutically.
MacDonald’s team has generated stacks of data on what can modify disease progression in HD. They are sharing all their data so that scientists all over the world can work together on it – many pairs of eyes are always better than one. Serendipitously, MacDonald identified people that have reduced expression of HTT. These people are just fine, so researchers know that reducing HTT to at least that level shouldn’t have detrimental effects. Since HTT expression levels vary within the population and people seem to be just fine, this is really good news for HTT lowering strategies. It suggests that altering HTT levels might not have negative side effects. One thing to note though, is that when HTT is lowered (specifically in liver), the cells are less able to sustain stress in mouse models. So again, it’s very important for researchers to test safety thoroughly for all HTT lower strategies.
Because HTT expression levels vary within the population, researchers also need to be aware that the starting levels of HTT for patients in HTT lowering trials may differ. So one could imagine in the future a more personalized approach may be adopted for each patient. These are all points that companies running HTT lowering trials are considering in their trial design. We all look forward to hearing more updates from these trials in the afternoon session.
Thursday afternoon – taking huntingtin lowering into the clinic

Good afternoon! This session focuses on translating HTT lowering to the clinic. Our first talk is by Charlotte Sumner from Johns Hopkins. She’ll be discussing some of the challenges associated with targeting genes therapeutically.
While Sumner primarily focuses on a different neurodegenerative disease called spinal muscular atrophy (SMA), there’s currently an ASO treatment for SMA so the HD field can learn a lot from watching what they’re doing. Similarly to HD, we know the precise genetic causes for SMA. However, our understanding of what’s happening with the protein molecules in the cell is much more hazy so the drivers of disease are not completely clear. Because the genetics are clear, there are a number of different gene therapies which have been developed for SMA. In addition to an approved ASO therapy, there are also small molecules (taken in a pill) which lower the target gene currently under review at the FDA. A single dose or “one-shot” gene replacement therapy which fixes the DNA sequence directly has also been shown to work well in young children with SMA and work is ongoing to see if this treatment would work well for older patients. Some patients in the SMA trials improved dramatically across various metrics that were measured. These findings are very encouraging for the field of HD research, where we hope to apply some of the successful strategies they’ve found in the field of SMA. Earlier in the conference we tweeted about researchers who were interested in determining when is the best time to treat HD. In the field of SMA they’ve found that timing really matters, so it’s great to see that HD research is on the right track.
Because some SMA patients have responded differently to treatments, SMA researchers are keen to get more patient data to understand potential reasons for this variation. This reinforces why studies such as Enroll-HD will be helpful for HD research. Now SMA researchers are trying to work out the best way to treat and monitor their patients i.e. how much of the medicine to give? When and how often should it be given? This should hopefully further improve patient outcomes. Again, similarly to HD, SMA researchers are interested in neurofilament as a biomarker for disease progression. They are monitoring neurofilament levels in patients who are treated with the different SMA therapies and neurofilament levels seem to drop over time with treatment.
The next talk is from Anastasia Khvorova who works at the University of Massachusetts Medical School and will be telling us about HTT lowering using a technique called RNAi. Similar to ASOs, RNAi-based therapeutics target the message of HTT rather than the DNA or the protein, acting to destroy the middle step so that protein is never produced. You can read more about RNAi and how it differs from ASOs here.
To test how the HTT-targeting RNAi affects disease, Khvorova and her team first analyzed the effects in mice. The first step was to measure how widely their treatment spread in the brain – very promising results! After treatment, they found HTT was significantly reduced in many areas of the brain. This work targeted both expanded and unexpanded HTT, but they’re also working on approaches that will just target expanded HTT. Making some clever tweaks to the RNAi molecules, Khvorova and team were able to make their treatment selective for just the expanded HTT message so that only this protein is lowered, not the unexpanded. However, it should be noted that this will only work in ~35 % patients who have a slight difference in their huntingtin gene sequence called a SNP (pronounced “snip”). This allows the RNAi treatment to select for the expanded over the unexpanded HTT. Next they wanted to see how their RNAi treatment worked in larger animal models, so they moved from mice to sheep. Using sheep they tested various delivery methods for the treatment finding they could inject into the brain or CSF and it works the same.
After sheep, Khvorova and colleagues moved into monkeys and again saw that the RNAi treatment spread fairly nicely across the brain and through the spinal cord. It stays in these regions for quite a long time so they don’t expect to have to treat very frequently.In a very early safety study in these monkeys, the therapy seems safe at the dose tested. Similarly, early data from a sheep safety study showed the therapy was safe under the conditions that the scientists tested. The exciting news is that HTT is significantly lowered in these early studies in monkeys. The levels of other genes seem to be unchanged which means the off-target or side effects appear to be low in the way the scientists measured in their experiment. Nonetheless, looking for even small changes in other genes is really important so work is ongoing by Khvorova and colleagues to make sure that there are no differences and confirm the safety of this therapy. This technology is thought to be very promising by Khovrova and colleagues, as well as CHDI. It could be used to change the levels of other proteins in the brain such as those identified as modifiers for symptom onset in HD patients or other targets. One of the things they’re paying attention to is cost. They’re trying to keep the cost down so it can be widely available to all HD patients. We’re really looking forward to more updates about this promising research as they move toward the clinic!
Our next speaker is Astrid Valles-Sanchez from uniQure. She’ll be telling us about uniQure’s approach to lower HTT. UniQure has a treatment called AMT-130 to lower HTT and is currently performing a clinical trial to determine the safety of this treatment. AMT-130 is designed to be a one-time injection of HTT lowering treatment into the brain. Valles-Sanchez is focusing her talk on biomarkers they’re assessing to measure how effective this treatment will be to modify HD disease progression. When they look in a pig model, they find that their treatment is detected in the CSF out to 2 years. In monkeys, they detected their treatment out to 6 months, when the animals were sacrificed. Similarly to other studies, uniQure want to check that their therapy is spreading out across the brain to see where it might be working. In the pig model 12 months after treatment, they analyzed tissue from different areas across the brain to see how effectively their treatment lowered HTT. They find significant lowering of expanded HTT with the strongest lowering in brain regions most affected by HD. uniQure also looked at expanded HTT levels in the CSF after treating HD pig models with AMT-130, but in this particular experiment, the levels in the CSF do not correlate to levels of HTT found in the brain. Scientists at uniQure are interested in using magnetic resonance spectroscopy (MRS), a non-invasive way to look at the brain, to see whether there are any changes in chemicals called metabolites that are found in different areas of the brain after treatment.
The final talk of the conference is from Scott Schobel who will be telling us about some very preliminary new results from the Roche trial. These results come from a 15 month open label extension in manifest (symptomatic) HD patients, we should be a bit cautious in interpreting this data as its still very early days, but its exciting nonetheless to see what they found.
And thats is for this years HD Theraputics Conference! Be sure to catch up on Day 1 here, and Day 2 here and keep up with the conversation on Twitter. As many projects in the field of HD research, this has been a large collaborative effort of many researchers working together to get this out. RG6042 has a new name! It’s called tominersen which is what the therapy will be called from now on. Patients in the original safety study were kept on an open label extension which means that after the safety trial ended, they continued to receive the therapy and the data we will see today is what scientists have found since the end of the safety study. Recap – this therapy is NOT selective for the expanded HTT gene, it is designed to lower both expanded and unexpanded huntingtin protein levels. Folks at Roche and their collaborators have been working for many years now with different animal models to work out how much they would need to reduce levels of huntingtin protein and how they might measure that lowering of protein by looking at the CSF. It was two years ago at the CHDI meeting that Sarah Tabrizi from UCL delivered the first results of the safety study. In just 2 short years we’ve made huge advances in HTT lowering with many strategies now available – very exciting!
From the safety study, it looked as though HTT protein levels could be reduced with tominersen in a dose-dependent manner. This means that the protein was lowered more in patients who received more of the treatment in the small number of patients tested. The open label extension tested 2 dosing strategies – participants either were dosed either every month or every other month. This type of design was critical for determining how often patients would need to take tominersen. They found that good huntingtin lowering was observed even when tominersen was taken every other month. The two patient groups had very few folks not complete this extension study – we are all grateful to these patients for their commitment to the trial! Given the metrics that Roche examined, the data indicates that tominersen should be taken every other month rather than every month. Because they found the less frequent dosing was effective in lowering HTT, they modified the strategy for the next arm of the study (Phase III) to reduce the number of doses and test dosing every 16 weeks – much less demanding for patients!
Tracking levels of neurofilament, a proposed HD biomarker to monitor disease progression, could be helpful to see how effective the treatment is and Roche are continuing to investigate neurofilament levels in the clinical trial. They found that NFL levels have an initial rise, but amounts seem to decrease and even out by the 15 month mark. Roche are interested in understanding the NfL biomarker further and are looking into the underlying biology which might link HTT and NfL. There is more clinical work in the pipeline at Roche which will hopefully continue to inform HD researchers about how effective this therapy might be. Schobel has kindly shared his slides online!
And that’s all folks! We hope these live tweets have been helpful for you all to follow along, we’re excited for next year already!




