
2018年亨廷顿病治疗学会议 – 第3天
亨廷顿病治疗学会议第3天最新进展:亨廷顿蛋白——及其降低
2018年亨廷顿病治疗学会议最后一天,早上好!今天有两场会议,第一场聚焦于HD基因产生的蛋白质。第二场将包括Wave Life Sciences和Ionis Pharmaceuticals关于亨廷顿蛋白降低试验的最新进展。
周四上午 – 亨廷顿蛋白
每位亨廷顿病患者都遗传了相同的突变——C-A-G序列的延长。这种扩增发生在我们现在称为HD基因的基因中。细胞利用基因作为制造蛋白质的指令——今天的第一场会议将聚焦于HD蛋白。

格勒诺布尔阿尔卑斯大学的桑德琳·亨伯特长期以来对大脑发育以及HD基因和蛋白质如何影响这一过程感兴趣。为了理解这一过程,亨伯特的实验室培育了一种大脑中缺乏HD基因和蛋白质的小鼠。他们发现,缺乏HD基因的细胞以异常方式分裂和移动。在大脑发育过程中,新生的细胞会爬向其正确位置,通常沿着其他细胞形成的“绳索”攀爬。当HD基因被删除时,这一过程会发生改变,这表明HD基因在此过程中扮演着重要角色。
IRBM科学园的安德里亚·卡里卡索莱正在对亨廷顿蛋白的“翻译后修饰”进行大规模研究。这指的是亨廷顿蛋白上微小的化学“修饰”。这些修饰使细胞能够微调蛋白质的功能。例如,亨廷顿蛋白可能带有数十种此类标签,它们被添加和移除,以响应各种信号来微调亨廷顿蛋白的功能。许多这些修饰对亨廷顿蛋白有奇特的影响,甚至可以阻止突变亨廷顿蛋白损害细胞。我们之前在HDBuzz上撰写过相关文章。卡里卡索莱的团队正在开发针对单个亨廷顿蛋白修饰的非常灵敏的检测方法。这些方法使他们能够追踪哪些修饰在疾病进程中发生了变化,并可能寻找修复它们的方法。
华盛顿大学的罗希特·帕普对理解亨廷顿蛋白采取了非常集中的方法。他的实验室正在开发工具,以研究蛋白质中受HD突变影响的部分的形状。帕普的实验室利用大量的计算能力来尝试预测受突变影响的亨廷顿蛋白部分的形状。这些技术使他们能够观察到一种“蝌蚪”形状。这种蝌蚪形状一直是亨廷顿病领域激烈争论的焦点!帕普的技术强烈支持这场争论的一方,这必将有助于我们更好地理解亨廷顿蛋白的这一关键部分。
埃默里大学的李晓江开发了一种有趣的小鼠模型,可以在成年小鼠的大脑、身体或两者中关闭亨廷顿基因。这些小鼠没有扩增的亨廷顿基因——它们只是帮助我们理解关闭“健康”版本的基因是否会产生后果。令人欣慰的是,当基因被关闭时,大脑中没有发生任何不良情况。出乎意料的是,关闭基因导致了胰腺炎症。目前尚不清楚这对患者意味着什么,但目前的亨廷顿蛋白降低疗法预计不会显著降低身体中的亨廷顿蛋白水平——只降低大脑中的。李还利用CRISPR-Cas9基因编辑技术从小鼠HD基因中剪除了有害片段。灭活小鼠体内的突变基因成功减少了有毒亨廷顿蛋白的形成,小鼠的活动能力也得到了改善。李博士一直很忙!他还利用CRISPR基因编辑技术制作了亨廷顿病模型猪。这可能有助于测试新药,因为猪脑与人脑相似。
“科哈内克冷冻了这种蛋白质,并使用电子束拍摄了数千张照片。然后通过计算机将这些照片组合起来,首次呈现了亨廷顿蛋白详细的分子结构。”
加州大学圣地亚哥分校的安库尔·贾恩研究RNA——当细胞想要利用DNA中的指令制造蛋白质时产生的“信使分子”。我们的DNA存在于细胞核中,但RNA在整个细胞中自由漂浮。许多遗传性脑疾病的传统观点是它们由有毒蛋白质引起,但越来越多的证据表明,有时突变基因产生的RNA信使分子也可能具有毒性。例如,一些RNA序列可以粘附在重要的蛋白质机器上,阻止它们在细胞中发挥作用。有毒RNA的一个可能迹象是亨廷顿病和其他脑疾病细胞中观察到的异常RNA团块的形成。贾恩发现,他可以通过像制作果冻一样加热和冷却RNA来形成人工RNA团块。这些团块只有当RNA包含像亨廷顿病中CAG重复序列那样的粘性序列时才会形成。目前尚不清楚这些RNA团块是否对亨廷顿病有害,但它们可能有害。例如,如果RNA滞留在细胞核中,就无法用于生成蛋白质。反义分子(类似于目前在亨廷顿病人体试验中的那些)可以粘附在细胞核中的RNA上,阻止它们形成团块。理论上,其他药物也可以用于解决脑疾病中的RNA粘性问题。
斯特凡·科哈内克(Stefan Kochanek)现在带来了一场激动人心的最新演讲,他的实验室刚刚揭示了亨廷顿蛋白的结构!了解蛋白质的形态是理解它们如何工作以及如何通过药物改变它们的重要一步。亨廷顿基因于25年前被发现,但该蛋白质体积庞大、不稳定且具有粘性,这使得其结构极难被揭示。一个团队甚至将这种蛋白质送入太空,试图使其结晶,但遗憾的是,未能成功。科哈内克的团队在其他人失败的地方取得了成功,他们的研究成果刚刚发表在《自然》杂志上。这一重大突破是利用另一种名为HAP40(“亨廷顿相关蛋白40”)的蛋白质来稳定亨廷顿蛋白。一旦用HAP40稳定后,科哈内克冷冻了这种蛋白质,并使用电子束拍摄了数千张照片。然后通过计算机将这些照片组合起来,首次呈现了亨廷顿蛋白详细的分子结构。这非常酷,为我们提供了大量可供研究的材料。不过有一个注意事项:有些区域仍然过于不稳定,无法确定其结构——包括蛋白质开头包含突变的所有重要部分。
周四下午 – 亨廷顿蛋白降低
随着亨廷顿蛋白降低疗法会议的开始,这一天和本次会议都迎来了高潮。亨廷顿蛋白降低是指旨在降低亨廷顿蛋白水平的方法。实现这一目标的方法有很多,但其中许多都以“RNA”为靶点,RNA是HD基因信息与亨廷顿蛋白之间的中间产物。
加州大学伯克利分校的迈克尔·拉普对诱导细胞破坏细胞内的单个蛋白质很感兴趣。在许多情况下,包括亨廷顿病,选择性地去除一种特定的蛋白质将非常有帮助。细胞有不止一种蛋白质降解途径——其中一种重要的途径是使用一种名为“泛素”的微小化学修饰作为标签。细胞将泛素识别为一种“吃掉我”的信号,并分解带有泛素的蛋白质。拉普的实验室一直致力于理解细胞如何使用泛素标签来标记需要快速降解的蛋白质——例如,可能是有毒的蛋白质。拉普的实验室已经开发出工具,首次让研究人员能够观察蛋白质通过这种快速降解途径的过程。快速蛋白质降解机制是一个强大的工具——拉普的实验室对此很感兴趣并希望加以利用。一种最近开发的技术——名为“PROTAC”——允许研究人员利用泛素系统驱动细胞破坏特定的蛋白质。
弗吉尼亚大学的斯科特·蔡特林利用亨廷顿病小鼠模型研究降低突变亨廷顿蛋白、正常亨廷顿蛋白或两者时会发生什么。请记住,每个人从父母双方各继承一个亨廷顿基因——大多数亨廷顿病患者带有一个正常拷贝和一个突变拷贝。科学家将健康/正常蛋白质称为“野生型”,因为它在自然界中更常见。这些问题很重要,因为所有亨廷顿蛋白降低疗法都旨在减少大脑中亨廷顿蛋白的总量。有些疗法,如Ionis的药物,同等程度地降低两种版本的蛋白质。其他疗法,如Wave的药物,则旨在更多地降低突变型蛋白质而非野生型蛋白质。我们认为单独降低突变蛋白或与野生型蛋白同时降低可能是有益的——但降低亨廷顿蛋白是否安全仍是一个悬而未决的问题。蔡特林培育了小鼠,在小鼠完全成年后,可以降低突变型、野生型或两种蛋白质的产生。蔡特林发现,早期降低突变亨廷顿蛋白对大脑中蛋白质的积累有更大的影响。同样,早期减少突变亨廷顿蛋白对小鼠的体重减轻和运动技能有更大的益处。对于减少两种版本蛋白质的产生也是如此——早期治疗有更大的益处。结论:在抑制亨廷顿蛋白方面,越早越好。在握力测试中,仅降低突变蛋白改善了表现,但同时抑制两种版本则没有。否则,两种方法大致同样有效,关键因素是治疗的早期程度。蔡特林还研究了如果允许亨廷顿蛋白反弹会发生什么,这对小鼠来说是不利的。这表明长期治疗优于短期治疗——这正是人们所期望的。
俄勒冈健康与科学大学的乔迪·麦克布莱德描述了她利用无害病毒向脑细胞传递指令,帮助它们制造自身RNA破坏分子的工作。这种方法的一个好处是,病毒理论上可以使RNA破坏分子永久生成,从而实现一次性治疗。麦克布莱德正在通过将治疗方法应用于猴子来研究,猴子拥有与我们更相似的复杂大脑。具体来说,她的团队正在研究将病毒递送到大脑中一个名为“壳核”的区域。壳核特别有趣,因为它是亨廷顿病中最脆弱的大脑区域之一——在遗传HD突变的人群中,该区域会发生大量萎缩。麦克布莱德描述了递送病毒所需脑外科手术的改进,包括在注射时使用MRI对大脑进行成像。病毒治疗使壳核中的HD基因RNA减少了约一半,这比之前的尝试有了显著改善。接下来是Wave Life Sciences的迈克·潘扎拉,他们正计划进行两项针对亨廷顿病使用“反义寡核苷酸”(ASOs)的试验。ASOs是短的、经过修饰的DNA片段,它们进入细胞并破坏目标RNA,从而降低目标蛋白质的水平。
潘扎拉告诉大家,Wave目前正在亨廷顿病患者中进行两项ASO试验。为什么是两项?Wave的方法依赖于靶向HD基因中的微小基因变异——称为SNP,或“单核苷酸多态性”。这些微小变异不会导致亨廷顿病,它们只是人与人之间正常遗传变异的一部分——这就是我们并非都是同卵双胞胎的原因。有趣的是,这些变异仅存在于每个人拥有的两个HD基因拷贝中的一个上。通过靶向这些变异,Wave的ASO可以区分HD基因的突变拷贝和非突变拷贝。Wave目前正在进行名为PRECISION-HD1和PRECISION-HD2的两项ASO早期安全性研究。这些研究中使用的ASO靶向HD基因中不同的遗传变异。这种方法的诀窍在于,患者不仅必须遗传了HD突变,还必须伴有允许突变基因拷贝被独特靶向的变异。因此,这些试验必然集中于携带这些变异的患者。Wave开发了非常酷的新技术来检测这些变异,并确定哪些变异位于HD基因的突变拷贝上,而不是正常拷贝上。Wave进行了一项初步研究,其中他们能够在64%的志愿者中找到其ASO的靶点。
“塔布里齐感谢首项研究中勇敢的志愿者,称他们为‘真正的研究英雄’,现场响起自发掌声。”
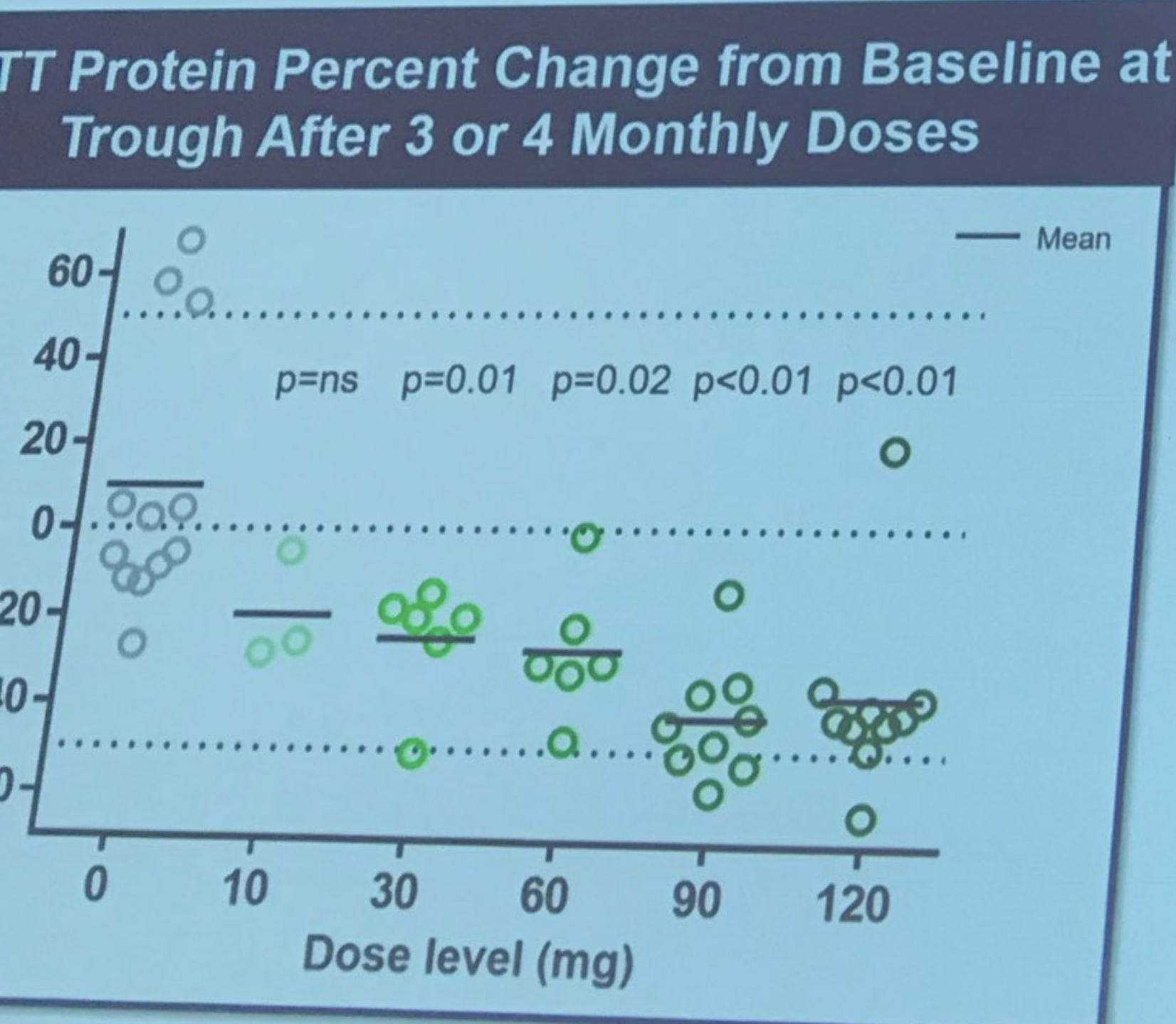
接下来,Ionis的安妮·史密斯和伦敦大学学院的莎拉·塔布里齐将介绍一项旨在测试靶向HD基因两个拷贝的ASO的试验结果。这是多年工作的结晶——史密斯提醒听众,Ionis项目始于2005年!他们从细胞和动物研究开始,这些研究提供了早期证据,表明ASO治疗可以降低亨廷顿蛋白,并改善亨廷顿病样症状。2012年和2013年发表的亨廷顿病小鼠模型研究结果表明,降低亨廷顿蛋白改善了亨廷顿病样症状。史密斯概述了Ionis Pharma决定使用靶向HD基因两个拷贝而非仅突变拷贝的ASO的逻辑。ASO的一个好处是它们在大脑中广泛分布。史密斯展示了猴子实验数据,表明在脊髓液注射后,ASO在大脑中广泛分布。Ionis还研究了在更大动物(如猪)中的分布,发现药物分布非常广泛。随后进行了毒性研究,表明长期给药耐受性良好(猴子研究中最长达15个月)。从接受ASO治疗的患者身上采集脑组织几乎是不可能的——那么我们如何知道ASO是否发挥了作用?史密斯描述了猴子研究,建立了大脑中亨廷顿蛋白降低与脊髓液中亨廷顿蛋白降低之间的关系。这使得Ionis能够构建一个非常复杂的计算机程序,以预测大脑和脊髓液中亨廷顿蛋白的降低程度,脊髓液可通过腰椎穿刺轻松获取。此时,Ionis与大型制药合作伙伴罗氏(Roche)合作,罗氏拥有运行复杂ASO人体试验的资源和经验。
莎拉·塔布里齐上台,介绍了Ionis/罗氏ASO治疗的首次人体试验。这项研究是一项“安全性”研究——进行这项研究的主要目的是确定药物是否安全。该研究在英国、德国和加拿大的9个地点进行。ASO通过“递增剂量”的方式注入患者脊髓液中,这意味着早期受试者接受低剂量,后期受试者接受高剂量。这种谨慎的剂量递增是为了让独立于研究的医生进行安全性评估。这项研究包括46名极其勇敢的志愿者,他们愿意承担成为首批接触该药物的人的风险。研究人员能够测量脊髓液中亨廷顿蛋白的水平——他们此前已证明这与大脑水平(请记住,我们无法直接测量)高度相关。
降低幅度非常显著——平均高达40-50%!塔布里齐描述了研究人员的感受,即亨廷顿蛋白的降低可能在长达6个月的时间内持续改善。塔布里齐预测这在大脑蛋白质降低方面对应的量。Ionis建立了一种模型,使他们能够预测脊髓液和脑组织中亨廷顿蛋白降低之间的关系。这表明脑组织中亨廷顿蛋白的降低可能相当高。患者的安全性得到了非常仔细的监测,未发现重大不良事件。塔布里齐表示:“该药物在所有测试剂量下均安全且耐受性良好。”成功!所有研究受试者现在都进入了所谓的“开放标签扩展”阶段——安慰剂组的患者已转为接受药物治疗并将继续受到监测。塔布里齐感谢首项研究中勇敢的志愿者,称他们为“真正的研究英雄”,现场响起自发掌声。
这是一个结束会议的绝佳方式——罗氏和Ionis正计划进行下一项试验,旨在确定该药物是否能改善更多人群的亨廷顿病症状,未来令人无比兴奋。
更新:Ionis关于结果的社区声明。



