锌指药物能对抗亨廷顿病?两个研究团队报告在细胞和小鼠实验中取得成功
锌指药物在亨廷顿病细胞和小鼠中成功减少有害蛋白的产生
设计药物,指示我们的细胞减少有害的突变亨廷顿蛋白的产生,是治疗亨廷顿舞蹈症最有希望的方法之一。到目前为止,大多数降低亨廷顿蛋白的尝试都是试图“射杀信使”,而不是攻击信息的来源——DNA 本身。现在,两份关于在 HD 小鼠中获得成功的独立报告,推动了“锌指”药物的发展——该药物直接与 HD 基因相互作用。这项新技术还处于早期阶段:我们知道什么,以及未来面临哪些挑战?
锌指到底是什么?
锌是一种闪亮的金属,存在于“银”币、电池和白色油漆中。但我们自己的身体使用锌来实现一个有趣的用途——研究人员希望利用它来对抗亨廷顿舞蹈症。事实证明,锌对于使细胞能够控制我们 DNA 中不同基因的活性水平至关重要。
请记住,基因是一组指令,使用化学“字母”A、C、G 和 T 拼写。每个基因都有不同的字母序列,细胞使用含锌蛋白质来帮助根据其特定的字母序列控制单个基因。
当锌与基因控制蛋白结合时,它会形成“锌指蛋白”——之所以这么称呼,是因为它们可以插入 DNA 两条链之间的紧密凹槽中,并接触到它们所针对的序列。
单个锌指可以影响任意三个字母,具体取决于构成它的锌和蛋白质片段的排列方式。因此,一个锌指可以粘附到序列“ATG”,而另一个锌指可能粘附到“CAG”。
令人兴奋的是,单个锌指可以按顺序连接在一起。将这两个连接在一起,你最终会得到一个可以粘附在6个字母序列ATG-CAG上的分子。
设计师指纹
经过数十年对DNA和基因工作原理的破译和理解,科学家们现在可以创造合成锌指,使其能够与他们想要的任何DNA序列结合。
更重要的是,这些合成锌指分子可以被调整并与其他药物包装在一起,产生多功能的DNA结合工具,可以粘附、切割、粘合和阻断。
由于亨廷顿病是由单个缺陷基因引起的,它是锌指药物研究的良好候选对象。
当一个人的基因中出现拼写错误时,就会发生亨廷顿舞蹈症,该基因指示细胞如何制造一种特定的蛋白质——称为亨廷顿蛋白。当一个人的亨廷顿蛋白基因开始附近有太多的 CAG 连续排列时,就会根据基因中的指令产生一种有害的“突变”形式的蛋白质。
从源头阻断HD基因
两个研究团队——一个来自西班牙巴塞罗那的学术团队,另一个是来自加利福尼亚的生物技术公司Sangamo——刚刚宣布使用针对亨廷顿病基因的锌指药物的实验取得成功。
西班牙团队的研究结果最近发表在PNAS期刊上。Sangamo的发现在最近在新奥尔良举行的神经科学学会会议上发表,HDBuzz在现场聆听了报告。
两个团队都设计了锌指分子,这些分子会粘附到亨廷顿蛋白基因的“CAG 区域”,并指示细胞不要读取该基因。
选择和磨练锌指链,是为了尽可能多地粘附到有害的长 CAG 延伸区域,而不粘附到正常长度的延伸区域。西班牙团队巧妙地称之为“分子卷尺”方法。
经过一些化学调整后,每个团队都在培养皿中生长的细胞中测试了他们最佳的锌指配方。
“一旦锌指靶向了特定的 DNA 序列,理论上就可以实现许多令人兴奋的事情。”
病毒载体
不幸的是,科学家们不能仅仅设计和制造锌指药物,然后将其喷洒到细胞上,或放入药片中。作为蛋白质,锌指药物体积大、结构复杂且易碎。如果以片剂形式服用,药物会被消化系统分解。
即使通过血液注射,锌指蛋白也无法到达大脑,更不用说到达我们神经元的细胞核,而这正是它发挥作用所需要的位置。
为了解决这个问题,研究人员可以使用病毒“搭便车”进入细胞核。
在选择了想要的锌指蛋白链后,设计一个DNA序列来告诉细胞制造该特定蛋白质是相当简单的。然后这个DNA序列可以被插入到一种叫做AAV的病毒颗粒中,这种病毒是无害的,但善于感染神经元。
当病毒遇到合适的细胞时,它会将其DNA货物注入细胞,将细胞变成制造锌指药物的工厂!
细胞测试
西班牙团队在几种不同的基因工程细胞和亨廷顿病患者的皮肤培养细胞中改进了他们最好的锌指候选药物。Sangamo的研究人员也使用了这些HD患者细胞,以及来自HD小鼠模型的脑细胞。
两个团队的锌指药物都成功完成了降低含有长CAG序列基因活性的任务。
脱靶效应
这里可能存在一个问题。亨廷顿基因并不是唯一一个具有长CAG序列的基因——许多其他基因也有。因此,针对CAG序列的药物也可能关闭这些基因,这可能最终弊大于利。
亨廷顿蛋白基因的一个怪癖可能有助于避免这些“脱靶效应”。亨廷顿蛋白基因中的 CAG 区域恰好非常靠近基因的起始位置,锌指药物的作用在该位置最为强烈。
两个团队都进行了测量,以查看其他基因是否受到锌指药物的影响,结果总体上令人放心。与对突变型亨廷顿基因的理想作用相比,任何影响都很小。
进入小鼠实验
西班牙团队在研究中更进一步,在亨廷顿病小鼠模型中测试了他们最好的锌指候选药物。
他们给小鼠大脑注射了一次,注射物含有装有制造锌指药物DNA指令的病毒颗粒。
在注射部位附近的大脑中,突变型亨廷顿基因的活性降低了约50%。突变型亨廷顿蛋白质斑块的出现也减少了约40%。没有发现体重减轻等有害影响的证据,但研究规模太小,无法确定锌指药物是否改善了症状。
等一下——这不就是基因沉默吗?
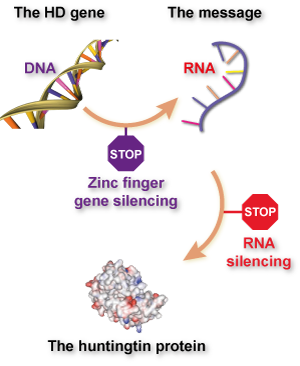
如果您在这里读到的关于锌指技术的文章让您想起了用于治疗亨廷顿舞蹈症的“基因沉默”或“降低亨廷顿蛋白”方法,那么给自己颁发一颗金星吧。这些小组尝试的基本上是“基因沉默”,但有一个转折——它直接针对 DNA,而不是针对称为 RNA 的“信息分子”。
到目前为止,大多数降低亨廷顿蛋白产生的尝试都集中在RNA信使分子上,因为设计针对RNA的药物比针对DNA的更容易。RNA以单链形式在细胞中漂浮,而DNA则隐藏在我们细胞的核内。此外,RNA沉默药物已经存在更长时间,有些不需要包装在病毒颗粒中。
既然基于RNA的基因沉默药物到目前为止都很成功,为什么还要费力去应对直接靶向亨廷顿基因DNA这个更大的挑战呢,特别是如果这意味着要处理病毒颗粒和由蛋白质制成的大型易碎药物?这是一个合理的问题,主要有三个答案。
第一个与追溯亨廷顿病的根源有关。我们确切知道亨廷顿基因中的突变是人们患上HD的最终原因。用锌指针对DNA意味着针对疾病的已知原因。虽然RNA是产生突变蛋白的必要步骤,但它与最终原因相距一步。锌指技术的支持者认为,尝试克服开发DNA靶向药物的额外障碍是值得的,因为最终结果可能更安全和更有效。
第二个涉及RNA。传统上,生物学家认为RNA不会直接做有用或有害的事情——它只是停在那里携带信息并被细胞机器读取。然而,我们现在知道事情不仅仅如此,有几种遗传疾病中RNA本身对细胞有直接毒性,而不仅仅是携带有害信息。
虽然所有人都同意突变型亨廷顿蛋白是亨廷顿病中造成伤害的主要原因,但一些研究人员认为亨廷顿RNA可能是额外的损害来源。其他人不同意这种观点,但如果RNA可能有害,那么防止它被产生似乎比事后清除它更理想。
最后一个原因是超越沉默。锌指的作用不仅仅是降低基因活性。一旦锌指锁定了特定的DNA序列,理论上可以实现许多令人兴奋的事情。
展望未来,锌指有可能被用来引导分子剪刀和胶水到达突变的 HD 基因,从而“剪掉”不需要的 CAG 重复序列。这被称为基因组编辑,是 Sangamo 和其他公司有兴趣追求的方法之一。
优势与劣势
我们采访的大多数 HD 研究人员都说,锌指作为一种治疗亨廷顿舞蹈症的方法“非常酷”,我们也倾向于同意。在 DNA 水平上对抗 HD,这是问题的根本原因,绝对是我们应该尝试的事情,我们很高兴在短短的时间内,两个小组都独立报告了进展。
重要的是要记住,完善这些技术需要很长时间,它们仍处于药物开发管线的早期阶段——而像基因组编辑这样的技术要在HD患者身上实现还需要几十年时间。
同时,HD领域的每个人仍然对全球正在进行的通过靶向RNA来降低亨廷顿蛋白水平的努力感到兴奋。这些技术已经发展得更远,很快就会进入人体试验阶段。



